MED-EL
Veröffentlicht Mai 10, 2021
Faszinierende Synchrotron-Bilder der Cochlea | Prof. Helge Rask-Andersen
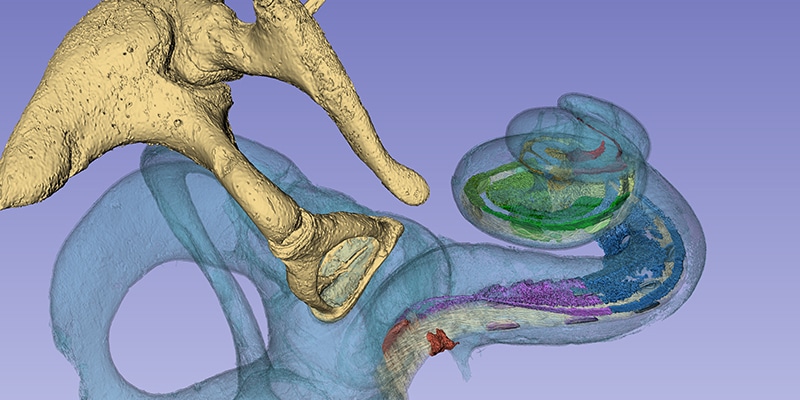
Heute haben wir die Ehre, einen beeindruckenden Beitrag von Prof. Helge Rask-Andersen mit Ihnen zu teilen. Rask-Andersen ist wissenschaftlicher Leiter der Abteilung für Experimentelle Otologie an der Universität Uppsala in Schweden.
Gemeinsam mit Prof. Sumit K. Agrawal präsentierte er kürzlich spannende Forschungsergebnisse zur Anatomie der menschlichen Cochlea. Beide Forscher bedienten sich mit ihren Teams eines gewaltigen Synchrotron-Teilchenbeschleunigers, um Bilder intakter mikroanatomischer Cochlea-Strukturen zu generieren, die in ihrer Detailliertheit völlig neue Maßstäbe setzen.
Eine der imposantesten Erkenntnisse dieser gemeinsamen Forschungen war die Bestätigung der These, dass das Ganglion spirale sich nahezu über die ganze Länge der menschlichen Cochlea erstreckt und am Beginn der zweiten Cochlea-Windung eine komplexe schraubenförmige Drehung aufweist.
 Mehr über diese Forschungsarbeit können Sie in diesem kürzlich in der Fachzeitschrift Nature erschienenen Artikel lesen: Three-dimensional tonotopic mapping of the human cochlea based on synchrotron radiation phase-contrast imaging. Hao Li, Luke Helpard, Jonas Ekeroot, Seyed Alireza Rohani, Ning Zhu, Helge Rask-Andersen, Hanif M. Ladak & Sumit Agrawal. Sci Rep 11, 4437 (2021). Bildverwendung lizenziert unter Creative Commons License 4.0.
Mehr über diese Forschungsarbeit können Sie in diesem kürzlich in der Fachzeitschrift Nature erschienenen Artikel lesen: Three-dimensional tonotopic mapping of the human cochlea based on synchrotron radiation phase-contrast imaging. Hao Li, Luke Helpard, Jonas Ekeroot, Seyed Alireza Rohani, Ning Zhu, Helge Rask-Andersen, Hanif M. Ladak & Sumit Agrawal. Sci Rep 11, 4437 (2021). Bildverwendung lizenziert unter Creative Commons License 4.0.
Dieses außerordentlich hochauflösende Bild bestätigt etwas, das wir seit mehreren Jahren in der CI-Forschung zur tonotopen Übereinstimmung von Frequenz und Stimulationsort beobachten: Erreicht ein Elektrodenträger die zweite Cochlea-Windung nicht, wird nicht das gesamte Ganglion spirale stimuliert, was wiederum bedeutet, dass nicht der gesamte natürliche Frequenzbereich der Cochlea stimuliert und genutzt wird.
Wir empfehlen Ihnen wärmstens, den gesamten Onlinevortrag (ca. 1 Stunde) anzusehen, da er einen unvergleichlichen Einblick in die Mikroanatomie und Physiologie des Innenohrs bietet und zugleich der Frage nachgeht, wie diese Erkenntnisse für eine noch exaktere CI-Anpassung und natürlichere tonotope Übereinstimmung nutzbar gemacht werden können.
Wenden wir uns jetzt aber den Ausführungen Rask-Andersens zu: Tauchen Sie ein in die komplexen Funktionen des Innenohrs und erfahren Sie, was diese neuen anatomisch-physiologischen Forschungsergebnisse für künftige Entwicklungen im Bereich der CI-Technologie bedeuten könnten.
Synchrotron-Bildgebung: Bis ins kleinste Detail
Ich traf Prof. Sumit Agrawal bei meiner Anatomie-Lehrveranstaltung 2017 in Uppsala. Ich habe meine Micro-CT-Bilder der menschlichen Cochlea präsentiert und Prof. Agrawal erwähnte, dass er sich an der Einrichtung für biomedizinische Bildgebung und Therapie (BMIT) der Kanadischen Lichtquelle (CLS) im kanadischen Saskatchewan mit Synchrotron-Bildgebung beschäftigt hatte.
Ich sah die Aufnahmen und war begeistert von der hohen Auflösung und der exakten Darstellung der weichen Gewebestrukturen in der Cochlea – sogar der lediglich 3 Mikrometer dünnen Reißner-Membran. 3 Mikrometer entsprechen in etwa dem halben Durchmesser eines Erythrozyten. Dies war möglich ohne Färbung, welche mitunter eine Schrumpfung verursacht.
Wir begannen schließlich eine Kooperation und verglichen unsere Forschungserkenntnisse. Synchrotron-Technologie kann Lichtmikroskopie und Histologie zwar nicht ersetzen, aber die Auflösung der Zellen kann durch Färbung und Fixierung weiter verbessert werden. Wir können die Mikroanatomie genauer erkunden und computerbasierte 3D-Rekonstruktionen erstellen, ohne dafür zeitaufwändige histologische Schnitte zu benötigen. Wir spielten die Serienaufnahmen in eine 3D-Analysesoftware ein, um das weiche Gewebe in der Cochlea dreidimensional betrachten zu können.
Die Cochlea lebt
Es war beeindruckend, das runde Fenster in 3D zu sehen und die Cochlea zu stimulieren, indem man sich quasi in ihr befindet und von innen heraus in Richtung Mittelohr blickt. Es hilft uns dabei, die Anordnung der Blutgefäße in der Cochlea nachzuvollziehen.
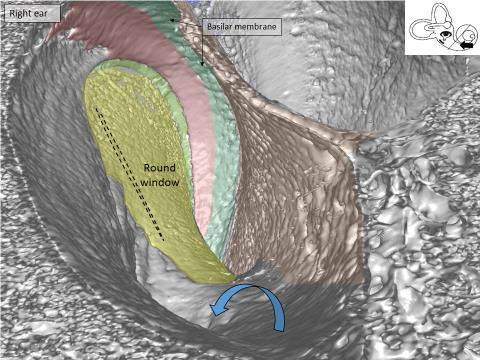
Synchrotron-Bild der Cochlea-Basis Innenperspektive: Als Betrachter ‚sitzt‘ man in der Cochlea und blickt nach hinten zum runden Fenster (gelb), wo der Elektrodenträger des Cochlea-Implantats eingeführt wird. Pfeile zeigen die knöchernen Öffnungen an, durch die die Blutgefäße am Boden der Scala tympani verlaufen.
Es ist bemerkenswert, dass wir unseren Puls im Ohr nicht permanent hören. Eine Art natürlicher Dämpfung verhindert, dass die Pulsschläge den extrem empfindlichen Haarzellen im Innenohr zusetzen. Die Blutgefäße sind sozusagen aufgewickelt und dehnen sich, um die Pulsschläge auszugleichen. Das Synchrotron zeigt, dass die Arterien sich wie kleine Sammelbehälter verhalten, um die Pulse abzuschwächen.
Damit verstehen wir nun die Herausforderungen rund um den Erhalt der Cochlea-Strukturen beim Einsetzen eines Cochlea-Implantats. Wir sehen venöse Gefäße in unmittelbarer Nähe zu jener Stelle, an der die CI-Elektrode eingeführt wird. Das Innenohr reagiert extrem empfindlich auf eine Störung der Durchblutung sowie Sauerstoffmangel. Es ist äußerst wichtig, diese Blutgefäße nicht zu beeinträchtigen, zumal sie Blut von den Nervenzellen ableiten, die durch das CI elektrisch stimuliert werden sollen.
Scala tympani, Scala vestibuli und Scala media
Die Cochlea ist eine spiralförmige Röhre mit zweieinhalb Windungen. Der Gesamtdurchmesser beträgt 9 mm. Würde sie ausrollen, hätte die hinterste Wand dieser Cochlea eine maximale Länge von 42 mm. Je nach Mensch kann die Länge der lateralen Cochlea-Wand aber deutlich variieren: zwischen 38 und 46 mm! Die erste Windung erstreckt sich über rund 22 mm, die zweite über rund 13 mm und der Apex über rund 7 mm.

Die Größe der menschlichen Cochlea kann sehr stark variieren!
Die Cochlea enthält zwei mit Flüssigkeit gefüllte Hohlräume, die sich zum Apex hin verjüngen: oben die Scala vestibuli und unten die Scala tympani. Die Scala tympani reicht bis zur Spitze der Cochlea, wo sie am Helicotrema, einem kleinen Loch, auf die Scala vestibuli trifft. So ist es möglich, dass die Druckwelle den gesamten Weg durch die Cochlea bis zum runden Fenster zurücklegt und jene sogenannte Wanderwelle entsteht, welche die Basilarmembran auslenkt und zentral ist für die Aufteilung der Frequenzen.

Auf diesem Synchrotron-Bild sehen Sie die Basilarmembran (grün), die durch Schallwellen in Schwingung versetzt wird und an der Basis nahe dem runden Fenster (rot) endet. Die Natur hat einen genialen Mechanismus eingerichtet, um die Membran am basalen Ende abzufedern, gewissermaßen in der Schwebe zu halten. Auf diese Art wirken sich die Bewegungen am runden Fenster nicht negativ auf die äußerst empfindliche Membran aus, welche die mechanischen Schwingungen in nanometergenauer Präzision auf die Sinneszellen überträgt.
Die Scalae sind durch die Lamina spiralis ossea voneinander getrennt. Diese Knochenleiste durchzieht den Cochlea-Kanal vom Modiolus bis zur lateralen Wand. Die Lamina reicht nicht ganz bis zur Hinterwand, sondern geht davor in die Basilarmembran über, die den einströmenden Klang zerlegt. Zwischen Scala vestibuli und Scala tympani verläuft die 3 Mikrometer (3 Tausendstelmillimeter) dünne Reißner-Membran.
Sie formt einen dritten Hohlraum, die Scala media. Sie beherbergt den eigentlichen Sitz des Gehörsinns, das geheimnisvolle Corti-Organ. Es besitzt keinerlei Blutgefäße. Alles spielt sich via Lateralwand und Stria vascularis sowie mithilfe der Lymphflüssigkeit ab.
Der Sinn dahinter, dass es mehrere Scalae gibt, besteht darin, einen geschützten, isolierten, mit Flüssigkeit gefüllten Hohlraum rund um den Sinnesrezeptorzellen zu schaffen, damit diese sich auf der ‚hüpfenden‘ Basilarmembran frei bewegen und zugleich mit Sauerstoff und Glukose versorgt werden sowie Metaboliten eliminieren können. Die Flüssigkeit liefert Kalium-Ionen, die anstelle von Elektronen als elektrische Ladungen für die elektromechanischen Prozesse in den Haarzellen dienen.
Die Sinneszellen begegnen dieser extrem mit Kalium-Ionen angereicherten Flüssigkeit mit einer starken elektrischen Polarität. 12.000 äußere Haarzellen ‚hüpfen‘ auf der Basilarmembran, während 3.4000 innere Haarzellen unbewegt auf der Spitze der knöchernen Lamina spiralis sitzen. Es ist bemerkenswert, dass ausschließlich die inneren Haarzellen von primär-afferenten Neuronen (die ins Gehirn gelangen, was in Innsbruck entdeckt wurde) innerviert werden und die Härchen oder Zilien der inneren Haarzellen sich biegen, wenn die Basilarmembran in Bewegung versetzt wird.
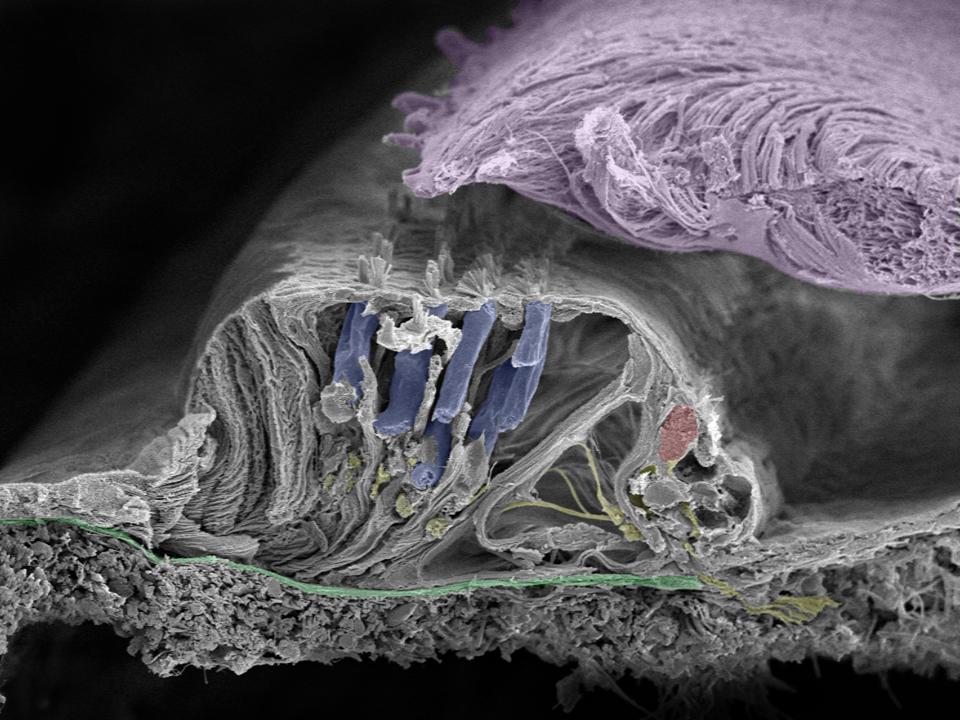
Detailaufnahme des Corti-Organs: Bewegungen der Basilarmembran (grün) bewirken eine Schubkraft in den Zilien, die sich von den Oberflächen der Haarzellen des Innen- (rot) und Außenohrs (blau) auf die Tektorialmembran (lila) fortpflanzt. Die Nervenfasern sind gelb gefärbt. Das Bild stammt von Helge Rask-Andersen, Anneliese Schrott-Fischer, Rudolf Glückert und Kristian Pfaller. Es wurde in Innsbruck mit einem Feldemissionsmikroskop aufgenommen.
Die Tektorialmembran sorgt durch Verschiebungen für eine Krafterzeugung. Sie besteht aus Kollagen und überlagert die Härchen der Haarzellen. Die Bewegungen der Zilien schaffen ein Rezeptorpotential in den inneren Haarzellen und führen potentiell zu einer Veränderung in den Nervenendigungen. Erreicht die Erregung einen bestimmten Schwellwert, erfolgt ein Aktionspotential, das sich entlang der nachgeschalteten Nervenfaser fortpflanzt. Solche Aktionspotenziale sind Ausschläge, die durch die Aktivierung der spannungsabhängigen Na+ Kanäle entstehen.
Jede innere Haarzelle ist mit zehn Nervenfasern verbunden und gibt pro Sekunde unglaubliche 100-1000 Botschaften, sogenannte Vesikel, an die Nerven ab. Der Transport dieser Botschaften wird durch Kalzium gesteuert. Jedes Bündel an Botschaften bewirkt einen elektrischen Ausschlag (ein Aktionspotenzial).
Die afferenten Nervenfasern verzweigen sich vom Ganglion spirale zu den inneren Haarzellen.
Nachdem beim Menschen die Zellkörper des Ganglion spirale nicht myelinisiert sind, kann angenommen werden, dass sie in der Lage sind, den elektrischen Reiz zu verstärken und weiterzuverarbeiten. Die Axone sind myelinisiert und Signale werden saltatorisch entlang der Natriumkanäle und Nodi weitergeleitet. Die Nerven kommunizieren mit Zellen im Hirnstamm und projizieren zu mehreren Nuclei im Hirnstamm sowie über den Thalamus im Zwischenhirn zur Großhirnrinde. Das Sprachsignal wird in der Peripherie konstituiert. Störungen wie zum Beispiel durch einen Tumor können zentral kaum kompensiert werden.
Noch komplexer als die Verarbeitung im peripheren auditorischen System sind die zentralen Verarbeitungsprozesse. Hierbei kommt es zu einer explosionshaften Entwicklung synaptischer Verbindungen während der kritischen Phase, auf welche die elektrische Stimulation bei Kindern abzielen sollte. Denn hier kommt es zur emotionalen und kognitiven Interpretation von Klang und Sprache.
Die zentralen Nuclei sind darüber hinaus wichtig für das Richtungshören, da sie Informationen von beiden Ohren verarbeiten. Menschen können Geräusche in der Frontalebene auf zwei Grad genau lokalisieren und interaurale Differenzen von 10 Mikrosekunden unterscheiden. Das klingt beeindruckend, ist aber nichts etwa verglichen mit Fliegen, die interaurale Zeitdifferenzen von sagenhaften 50 Nanosekunden unterscheiden können. Bei bilateraler CI-Versorgung liegt der Lokalisierungswinkel bei etwa 20 Grad.
Tonotope Tonhöhenwahrnehmung
Jede innere Haarzelle ist einer bestimmten Frequenz zugeordnet, da sie mit den entsprechenden Nervenfasern verbunden ist. Je weiter innen in der Cochlea die Nervenfasern stimuliert werden, desto tiefer wir die Tonhöhe wahrgenommen. Diese örtliche Kodierung ist für die gesamte Cochlea von Bedeutung. Zusätzlich zur örtlichen Kodierung lässt sich die Tonhöhe zeitlich kodieren (Ratenkodierung).
Die Wahrnehmung der Tonhöhe erfolgt sowohl in der Cochlea als auch im zentralen auditorischen System. Die menschliche Wahrnehmung unterschiedlicher Tonhöhen und Lautstärken ist enorm. Wir nehmen es wahr, wenn sich die Frequenz eines Tons um 0,7 % verändert.
Unterschiede in der Lautstärke nehmen wir im Bereich von 1 dB wahr. Der leiseste Ton, den wir gerade noch hören, markiert 0 dB (10-12 Watt/m2 bei 1.000 Hz).17 Das entspricht einem Druck am Trommelfell von 2 x 10-5 Pascal, also einem Milliardstel (1/1000 000 000) des normalen Luftdrucks. Ein solcher Ton lässt das Trommelfell etwa 10-8 mm schwingen. Diese Strecke ist kürzer als der Durchmesser eines Wasserstoffatoms. Am besten hören wir über 1.000 Hz (-9 dB). Das Synchrotron zeigt, dass in der für diese Frequenz zuständig Region in der Cochlea eine überaus hohe Zahl an Nervenzellen sitzen. Theoretisch müsste es (unter idealen Bedingungen) möglich sein, mit dem menschlichen Ohr einen Ton mit 120 dB über eine Entfernung 500 km zu hören.
Wenn wir rund 1.000 bis 1.500 Frequenzen und zugleich hunderte unterschiedliche Lautstärken zu unterscheiden imstande sind, bedeutet dies, dass 3.400 innere Haarzellen (die alle auf einem Stecknadelkopf Platz hätten) gesamt mehr 100.000 Klangmodalitäten unterscheiden können.
Außerdem ergibt sich daraus, dass auf der Basilarmembran ein Bereich von etwa 20 Mikrometer für eine erkennbare Frequenz steht (zwischen den 3.400 inneren Haarzellen liegen jeweils 10 Mikrometer).
Die Haarzellen dehnen sich hier auf einen Bereich von 31,5 mm aus. Von Mensch zu Mensch gibt es allerdings eine Varianz von 25 bis 35 mm. Da die Länge der Membran eine Varianz von bis zu 10 mm aufweist, können die tonotopen Frequenzpositionen logischerweise nicht einfach auf Basis der Gesamtlänge der Cochlea bzw. des Abstands zur Cochlea-Basis ermittelt werden.
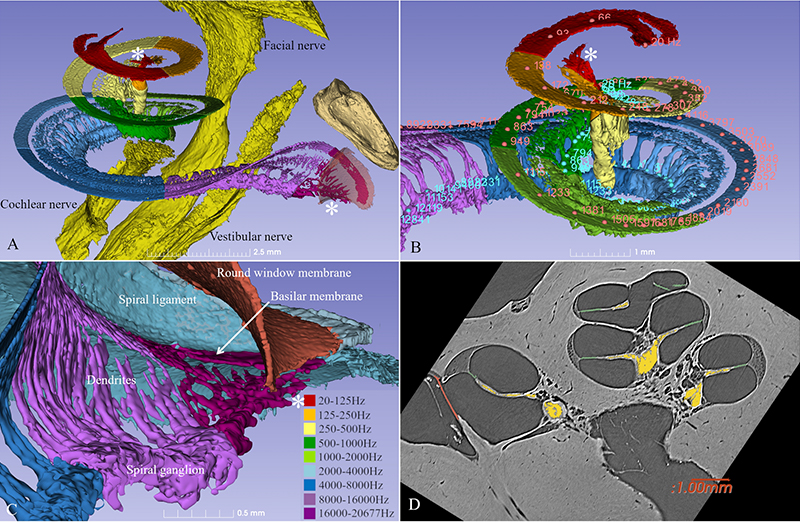
Prof. Greenwood entdeckte, dass die Frequenzpositionen entlang der Cochlea nicht linear, sondern logarithmisch verteilt sind, und fertigte eine entsprechende tonotope Karte an. Die Lokalisierung einzelner Frequenzen hängt demnach von der prozentuellen Distanz zum Apex ab. Mit dem Synchrotron konnten wir diese Frequenzverteilung im menschlichen Ganglion spirale kürzlich darstellen.
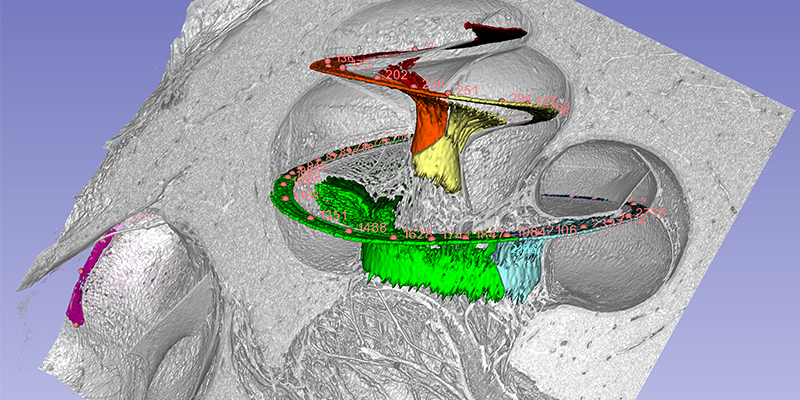
Die Cochlea verfügt über 2 3/4 Windungen, was 990 Grad entspricht. Die ersten beiden Windungen (720 Grad) entsprechen der Spitze des Ganglion spirale (s. Abbildung). Die tonotope Frequenz des Corti-Organs liegt bei einer Windung und rund 920 Hz (Stakhovskaya et al. 2007). 540 Grad entsprechen 407 Hz, 720 Grad (zwei Windungen) 152 Hz. Im Ganglion spirale korrespondieren 848 Hz mit 260°, 284 Hz mit 540° und 79 Hz mit 720°.
Dieses Wissen ist von größter Bedeutung für Cochlea-Implantate. Was zählt, ist die angulare Insertionstiefe der Elektrode. Tief eingeführte Elektroden sind wichtig für die niederen Frequenzen. Die Grundfrequenzen der Sprache sind hier lokalisiert und unsere Forschungen legen nahe, dass die Nervenzellen in diesem Bereich einige Besonderheiten aufweisen.
Greenwood fand außerdem heraus, dass die Cochlea über sogenannte kritische Bandbreiten verfügt (bei Normalhörenden getestet). Demnach lässt sich die menschliche Cochlea als eine Art Filterbank mit größeren Filtern in den hohen Frequenzen betrachten. Dabei handelt es sich um Bandpassfilter. Die Basilarmembran wird also nur in einem begrenzten Bereich aktiviert. Die Frequenzen oberhalb und unterhalb werden gesperrt und lassen sich nicht abdecken.
Damit verstehen wir besser, wie unser Ohr Sprache filtert und insbesondere in geräuschvoller Umgebung zerlegt und aufschlüsselt.
Neue Erkenntnisse: Die gesamte Länge des Ganglion spirale
Wie erwähnt, ist jede innere Haarzelle mit zehn Nervenfasern verbunden. Die afferenten Nervenfasern verzweigen sich vom Ganglion spirale zu den inneren Haarzellen.
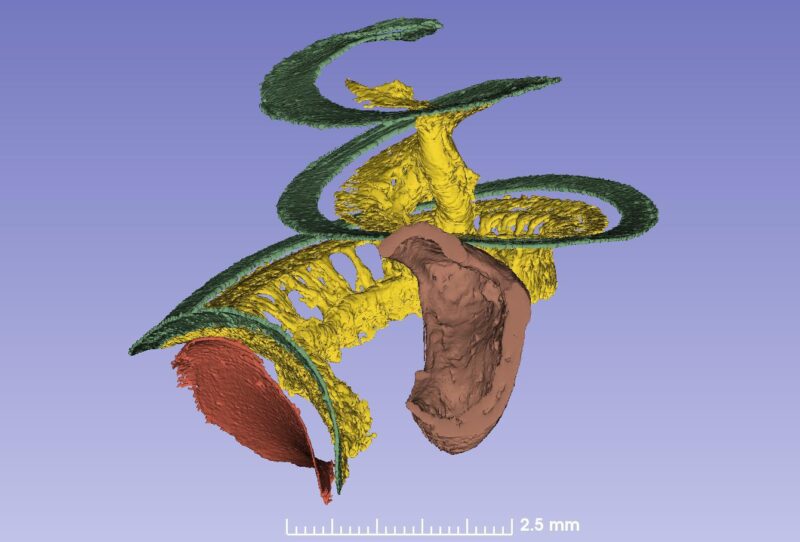
Das Ganglion spirale umfasst etwa 35.000 neurale Zellkörper, welche die Haarzellen beliefern. Die Zellkörper verlaufen in einem spiralförmigen Kanal und dehnen sich auf eine Länge von 13-14 mm aus. Sie sind extrem gut durchblutet. Das Blut wird vom Gehirn über zwei kleine Gefäße zu Basis und Zentrum (Modiolus) der Cochlea transportiert.
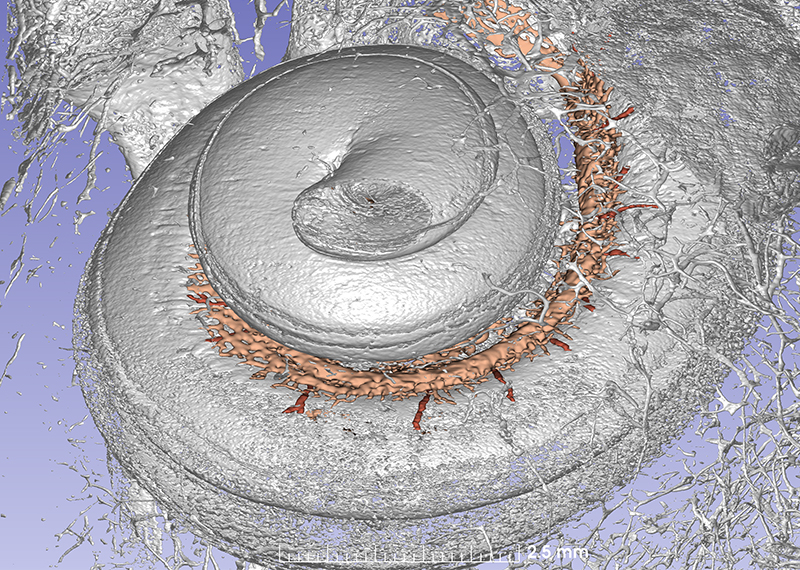 Dieses Synchrotron-Bild zeigt die Cochlea mit den Gefäßkanälen. Mehrere radiale Arterien versorgen das Gewebe mit Blut.
Dieses Synchrotron-Bild zeigt die Cochlea mit den Gefäßkanälen. Mehrere radiale Arterien versorgen das Gewebe mit Blut.
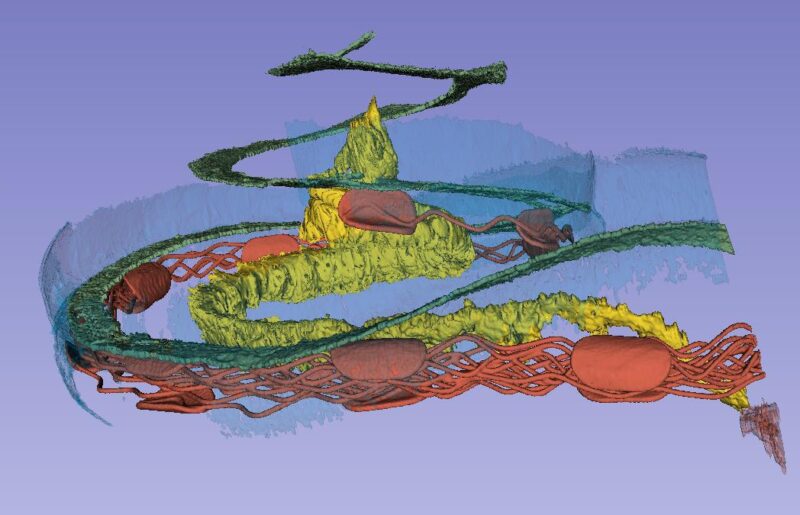
Die Basilarmembran (grün), das Ganglion spirale (gelb) und eine partiell durch das runde Fenster eingeführte Elektrode. Der Knochen ist hier nicht abgebildet. Blau dargestellt ist die „Batterie“ der Cochlea, die in der lateralen Wand sitzt und die elektrische Energie für 15.000 Rezeptorzellen produziert. Sie wird durch Blutgefäße versorgt, die vom Gehirn kommen.
Lange wurde angenommen, dass das Ganglion spirale sich nur über 1 3/4 Windungen erstreckt. Die Synchrotron-Aufnahme zeigt aber, dass das Ganglion spirale gleich viele Windungen hat wie die Cochlea selbst. Der einzige Unterschied besteht darin, dass die Spitze extrem komprimiert ist und die Zellkörper dort spiralförmig angeordnet sind und sehr nahe beieinanderliegen (Bild 2). Überraschenderweise scheinen manche Zellkörper am ‚falschen‘ Platz entlang zentraler Axone zu liegen.
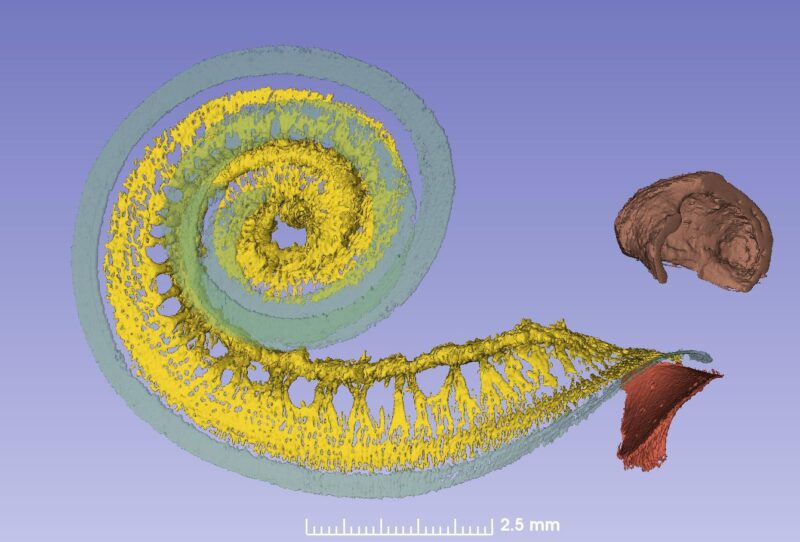
Aus den Synchrotron-Bildern lässt sich auch vom Ganglion spirale eine tonotope Karte erstellen, wenn man den peripheren Zellfortsätzen oder Axonen folgt. Bis zu einer Frequenz von 880 Hz (eine Windung) kann dies recht einfach bewerkstelligt werden, zumal die Fasern hier radial verlaufen. Nach der ersten Windung verlaufen diese aber spiralförmig, was die Aufzeichnung der Tonotopie erschwert.
Die erste Windung enthält 60 % der Nerven, die übrigen 40 % sind komprimiert. Die oberen zwei Windungen beherbergen neuronale Zellkörper, die sich lediglich über 2,5 mm des Ganglion spirale erstrecken.
Diese deutliche apikale Kompression stellt Cochlea-Implantate vor ein Problem: Sie erschwert die selektive Ansteuerung bestimmter frequenzkodierter Neuronen. Die peripheren Axone im Sinne eines möglichst breit abgedeckten Frequenzspektrums gezielt zu befeuern, ist eine große Herausforderung.
Akustisch-elektrische Vergleichstests bei CI-Nutzern mit Resthörvermögen zeigen, dass die angulare Insertionstiefe wichtiger als die absolute ist, wenn es darum geht, die Tonhöhenwahrnehmung abzuschätzen und die Frequenzstimulation der Elektrode vorherzusagen. Zwar gibt es eine Verlagerung der Frequenzen nach unten – je näher die Elektrode allerdings an der Basilarmembran liegt, desto geringer ist die Abweichung zwischen Tonhöhe und Insertionswinkel. Bei modiolarer Positionierung der Elektrode ist die Abweichung höher (Boëx et al. 2006).
Unsere 3D-Betrachtungen des Spiral-Ganglions mit all seinen Unregelmäßigkeiten und der apikalen Kompression könnte einige der Ergebnisse erklären. Am Ende der ersten Windung zeigt sich der Wechsel von radialen zu spiralförmigen Dendriten. Das deutet an, dass die Ansteuerung von peripheren Nervenfasern an einem tieferen Punkt die Frequenzverschiebung nach unten zusätzlich erklären könnte. Um diese zu vermeiden, wäre es wohl besser, die entsprechenden Neuronen stärker lateral zu stimulieren. Eine lateral platzierte Elektrode nahe der Basilarmembran läge näher an den zugehörigen peripheren Nervenfasern als eine perimodiolar platzierte.
Phasenverriegelung in der zweiten Windung
Werfen wir nun einen Blick darauf, wo die neuralen Spannungsspitzen erzeugt werden. Wenn die Erzeuger der Spannungsspitzen (Spike-Generatoren) auf die Habenula perforata nahe der Haarzellen zielen, wäre es am besten, die Stimulation möglichst weit auszudehnen. Wenn hingegen Ganglionzellen oder der erste Ranvier-Schnürring eines Axons angesteuert wird, wäre eine Stimulation bis 720 Grad (oder weniger) ausreichend. Betrachtet man die Arbeit des ZNS, sieht es nicht danach aus, als wäre der Ranvier-Schnürring ein Spike-Generator. Die Anfangssegmente der neuralen Zellkörper können jedoch ebenfalls wichtige Spike-Generatoren sein – ähnlich wie Nervenzellen im Gehirn.
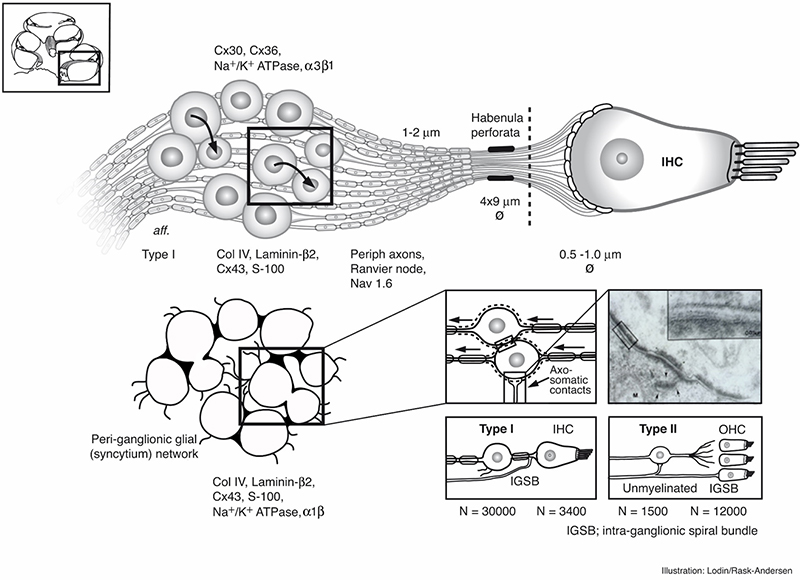
Organisation der inneren Haarzellen und Typ-1-Nerven im peripheren auditorischen System.
Fasern für tiefe Frequenzen werden durch sogenannte Phasenverriegelung auch ratenkodiert. Das bedeutet, dass die Aktionspotentiale sich im auditorischen Nerv immer in einem bestimmten Zeitabstand zu den niederfrequenten sinusförmigen Stimuli bemerkbar machen. Die Aktionspotentiale antworten also in einem fixen Zeitfenster auf die Erregungen.
Bis zu einer bestimmten Frequenzhöhe trfft diese Beobachtung auf alle Wirbeltiere zu. Das hat mit dem biologischen Substrat und den Eigenschaften der Zellmembran zu tun. Während die phasenstarre Simulation beim Menschen bis etwa 1.000 Hz erfolgt, reicht sie zum Beispiel bei der Eule bis zu 9.000 Hz. Neben der örtlichen (tonotopen) Kodierung müssen wir uns also auch mit der zeitlichen (Raten-)Kodierung der neuralen Signalverarbeitung befassen.
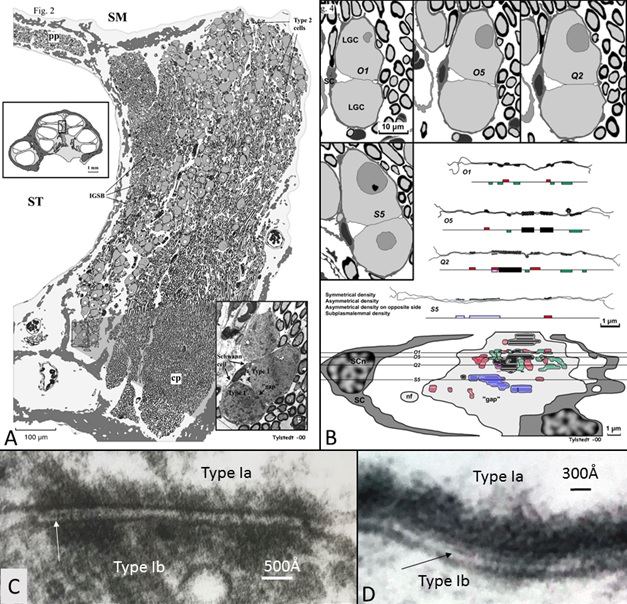
Diese Abbildung zeigt, dass der menschliche Hörnerv sich von jenem von Labortieren unterscheidet. Sie zeigt die obere Region des Hörnervs, der die tiefen Frequenzen kodiert. Nerven interagieren mit Verbindungen, die Synapsen ähneln (B-D). In dieser Region werden die Grundfrequenzen der menschlichen Sprache kodiert.
Die Grenzfrequenz könnte mit der Spiralform der peripheren Axone kongruieren. Unsere Ohren reagieren extrem sensibel auf Frequenzen um 1 kHz und wir sehen am Synchrotron-Bild, dass der für diese Frequenz zuständige Bereich (eine Windung) dicker ist, da er mehr Neuronen enthält. Der Umstand, dass sowohl Rate als auch Ort das Muster der Klangverarbeitung beeinflussen, macht elektrische Stimulation zu einer äußerst komplexen Herausforderung.
Interessanterweise sehen wir bei diesen tief in der Cochlea liegenden Neuronen anatomische Besonderheiten. Die Zellen kommunizieren miteinander und synchronisieren dabei das Signal. Das könnte für den Prozess der Phasenverriegelung wichtig sein. Am Bild sehen wir diese speziellen Areale, in denen die Neuronen auf einzigartige Weise direkt miteinander kommunizieren.
Vielen Dank, Herr Prof. Rask-Andersen, dass Sie diese spannenden Einblicke mit uns teilen!
Abonnieren, weiterlesen, teilen
Abonnieren Sie jetzt den MED-EL Professionals Blog und erhalten Sie regelmäßig Updates von MED-EL direkt in Ihren Posteingang.
Und lassen Sie sich den folgenden ExpertsOnline Vortrag zur anatomiebasierten Anpassung nicht entgehen:
MED-EL
War dieser Beitrag hilfreich?
Vielen Dank für Ihre Rückmeldung!
Abonnieren Sie den Newsletter unten.
Vielen Dank für Ihre Rückmeldung!
Hinterlassen Sie uns Ihre Nachricht unten.
Vielen Dank für Ihre Nachricht. Wir melden uns ehestmöglich bei Ihnen.
Schicken Sie uns eine Nachricht
Das ist ein Pflichtfeld
John Doe
Das ist ein Pflichtfeld
name@mail.com
Das ist ein Pflichtfeld
What do you think?
© 2023 MED-EL Medical Electronics. Alle Rechte vorbehalten. Der Inhalt dieser Webseite dient nur zur allgemeinen Information. Es werden keine medizinischen Ratschläge gegeben. Kontaktieren Sie bitte Ihren Arzt oder Hörspezialisten und lassen Sie sich dort beraten, welche Hörlösung in Ihrem Fall geeignet ist. Nicht alle der gezeigten Produkte, Produktfunktionen oder Indikationen sind in allen Ländern zugelassen bzw. verfügbar.
MED-EL



